近日,Plant, Cell & Environment杂志在线发表了亚热带农业生物资源保护与利用国家重点实验室、广西大学罗继景教授课题组的研究论文” Dual Transcriptional Circuits: G1-OsMADS34 and G1-TGW2 Cooperatively Regulate Sterile Lemma Identity and Grain Size in Rice”。针对水稻护颖发育特化分子调控机制仍未完全清楚的科学问题,本研究以水稻日本晴与具“类外稃退化稃片”(lsl)表型的品种LG7为亲本构建杂交群体,定位并克隆了控制该表型的关键基因G1。G1等位基因存在一个323G/A SNP变异,导致其编码蛋白DUF640结构域第108位丝氨酸替换为天冬酰胺(S108N)。G1基因编码一个植物特有的ALOG结构域转录因子,转基因敲除结果发现G1是调控水稻护颖发育特化的关键基因。对于G1控制护颖发育的分子调控网络研究发现,G1通过分别与OsMADS1(Qin et al, 2025, Plant Cell Reports)和OsMADS34启动子上的基序 YACTGTW和CArG-box结合调控这些下游基因的表达;同时,这两个基因所编码的蛋白又与G1互作形成负/正反馈调控回路,调控护颖发育。另外,我们还发现,G1与TGW2基因的启动子上的基序 YACTGTW和CArG-box 结合调控该基因的表达,而且TGW2基因所编码的蛋白也与G1互作形成正反馈调控回路,调控水稻籽粒的大小。该基因功能的缺失可在不影响主要农艺性状的前提下显著提高产量,为高产育种提供了重要靶点。

水稻是全球最重要的口粮作物,其产量与品质直接由小穗结构决定(Sreenivasulu et al., 2021)。典型水稻小穗包含一朵可育小花和两对特化苞片(护颖与副护颖),这一结构对籽粒发育与形态建成至关重要(Kyoko et al., 2004; Itoh et al., 2005)。水稻穗发育始于茎顶端分生组织向花序分生组织的转化,随后逐步形成各级枝梗分生组织、小穗分生组织,最终分化为花器官(Itoh et al., 2005)。护颖作为小穗关键组成部分,其发育依赖一个复杂的多基因调控网络,涉及转录因子、表观遗传调控及激素信号等多个模块(Zhuang et al., 2020; 罗曦 等, 2021; Li et al., 2025)。然而,该网络中基因的层级关系与互作机制尚不明确。本研究通过图位克隆方法获得一个调控水稻护颖发育的新等位变异位点基因G1,同时,我们深入揭示了该基因调控护颖发育特化的分子调控网络(Figure 1)。
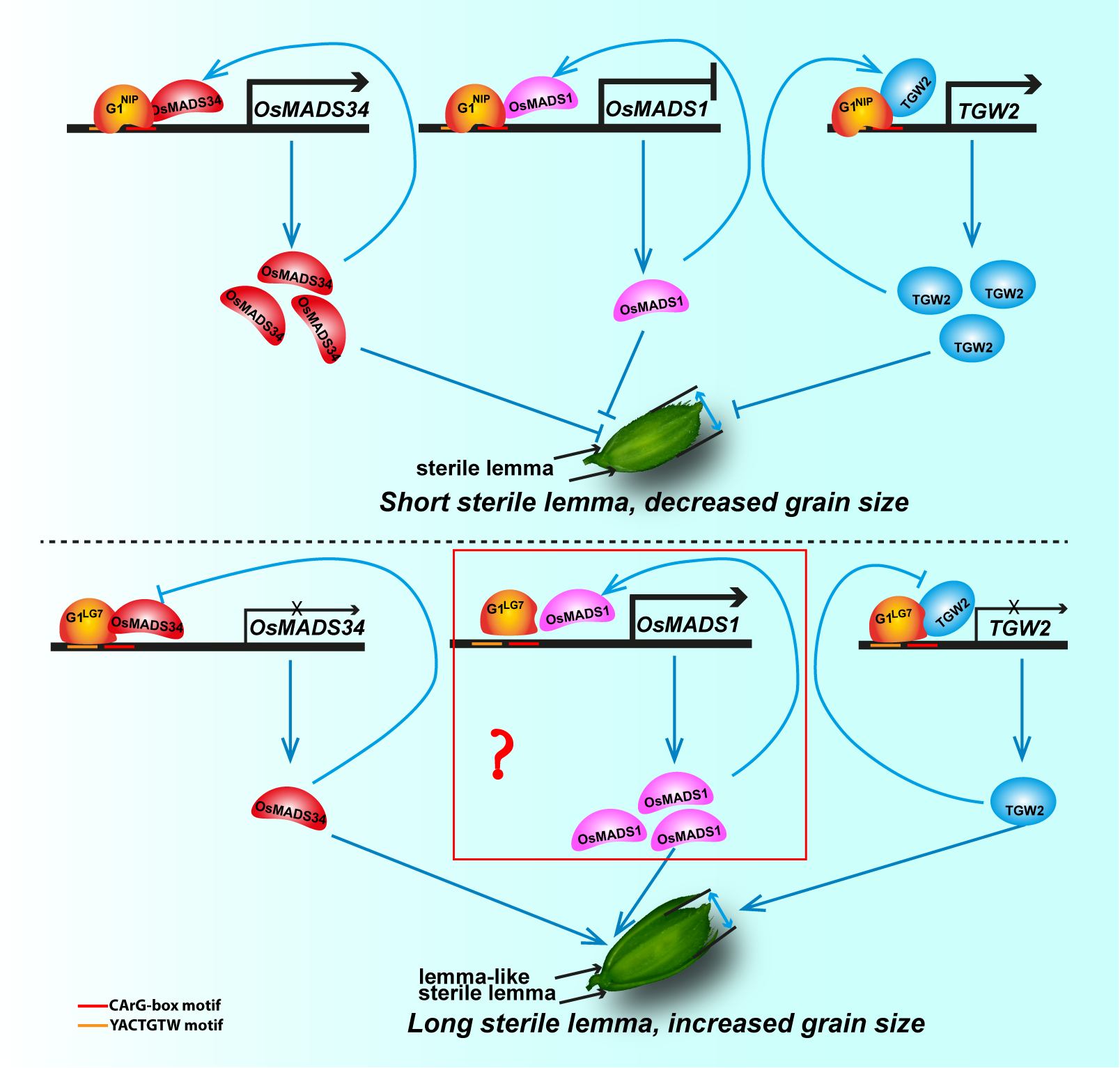
Figure 1. A proposed working model for G1-mediated regulatory network underlying sterile lemma specification.
通过进一步的遗传学分析发现,在g1/OE-TGW2双突变体中,籽粒大小更接近野生型(NIP),与g1突变体相比,OE-G1-1和g1/OE-TGW2水稻植株的粒宽、糙米粒长及糙米粒宽均显著减小,其籽粒大小恢复至与NIP相当的水平(Figure 2A、B、D、F)。从遗传层面证实了G1位于TGW2上游,并支持二者之间存在正向反馈调控。此外,与野生型相比,G1基因敲除突变体籽粒显著增大,其穗型、千粒重及单位面积产量均显著提升,而穗粒数、结实率等性状无显著变化,表明G1通过负调控籽粒大小影响产量,是水稻增产育种的重要靶点(Figure 2)。
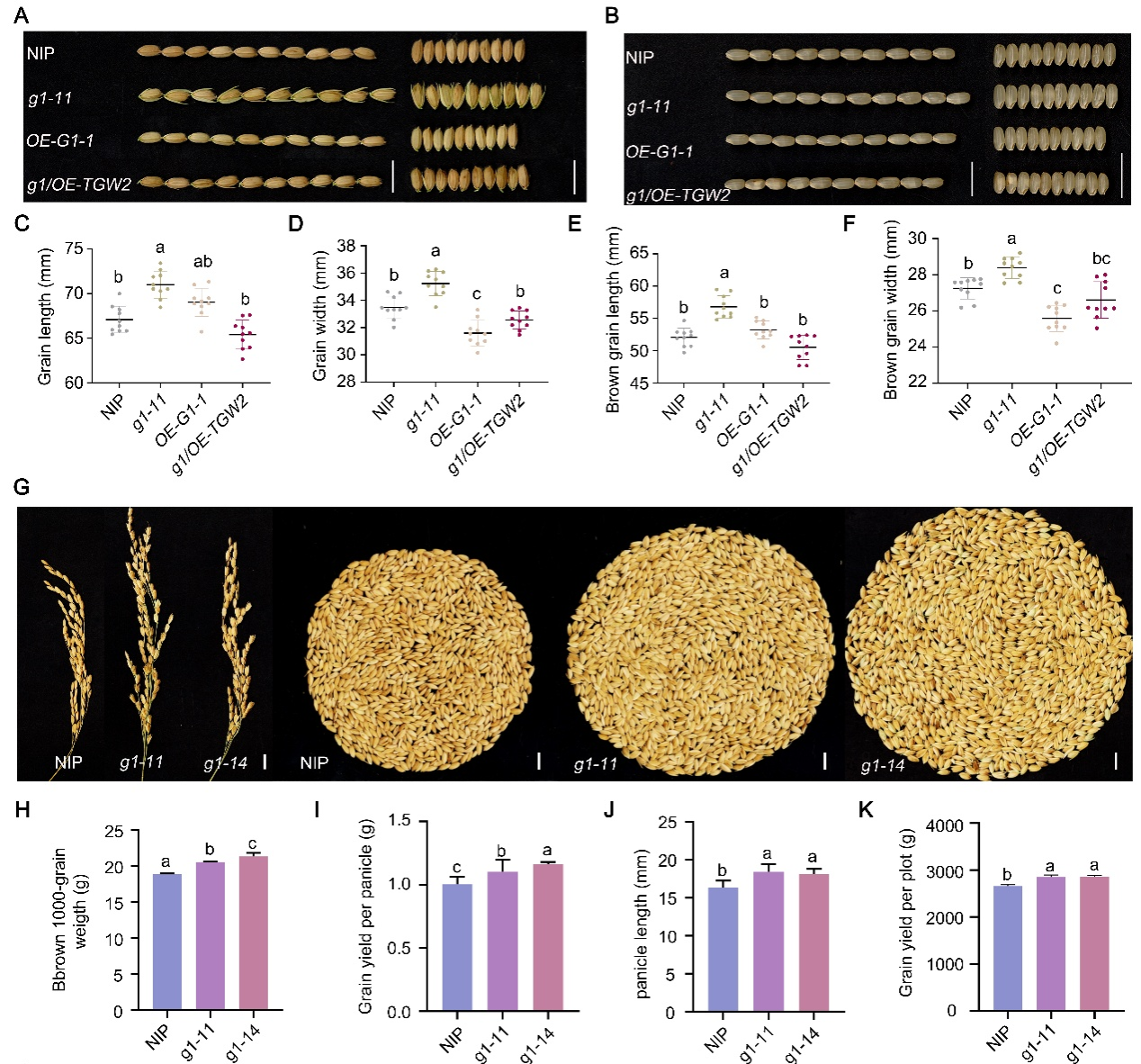
Figure 2. Phenotypic investigation of grain size
综上所述,研究团队首次阐明水稻G1通过靶向调控OsMADS1 (Qin et al., 2025)、OsMADS34和TGW2等多个关键基因,协同调控水稻护颖发育和籽粒大小。研究还发现,不同G1等位基因通过改变其转录激活或抑制能力而影响护颖长短与籽粒大小。
广西大学博士覃雪梅(已毕业)为该论文第一作者,广西大学罗继景教授为通讯作者。研究工作得到了国家自然科学基金(32260446, 31671646)和广西科技计划项目(2024GXNSFGA010003, Guike‐AD25069107, 2018GXNSFDA138004)等经费的支持。本研究中的长护颖水稻品种LG7由广西大学农发院蔡中全博士提供,在此一并致谢!
原文链接:http://doi.org/10.1111/pce.70364
广西大学罗继景教授课题组长期围绕区域特色的广西普通野生稻资源的搜集、保护与利用方面开展研究。目前研究方向主要集中在耐冷、耐旱以及细菌性条斑病抗性基因分子遗传的研究。近年来在Nature Genetics, The Plant Cell, Nature Communications和 Plant Biotechnology Journal等国际知名期刊发表SCI论文30余篇。本课题组招收遗传学、分子生物学和生物化学等方向硕士、博士及博士后,欢迎加入。

广西大学罗继景教授课题组全体成员
参考文献:
Fang, H., Chen, H., Wang, J., Li, N., Zhang, L., and Wei, C. G1 interacts with OsMADS1 to regulate the development of the sterile lemma in rice. Plants (Basel). 2024:13. https://doi.org/10.3390/plants13040505.
Hong, L., Qian, Q., Zhu, K., Tang, D., Huang, Z., Gao, L., Li, M., Gu, M., and Cheng, Z. ELE restrains empty glumes from developing into lemmas. J Genet Genomics. 2010:37101-115. https://doi.org/10.1016/s1673-8527(09)60029-1.
Itoh, J., Nonomura, K., Ikeda, K., Yamaki, S., Inukai, Y., Yamagishi, H., Kitano, H., and Nagato, Y. Rice plant development: from zygote to spikelet. Plant Cell Physiol. 2005:4623-47. https://doi.org/10.1093/pcp/pci501.
Kyoko, I., Hidehiko, S., and Yasuo, N. Developmental course of inflorescence and spikelet in rice. Jpn J Breed. 2004:54147-156.
Li, Z., Wang, Z., Wang, C., Zeng, X., Tang, J., Zhu, H., Lin, H., Zhu, S., Li, Y., Yao, P., Gao, Y., He, G., Zhuang, H., and Li, Y. LATERAL FLORET 2 encoding a sucrose non-fermenting 2 chromatin remodeling factor regulates axillary meristem of spikelet development in rice (Oryza sativa). New Phytol. 2025:246598-615. https://doi.org/10.1111/nph.20455.
Liu, M., Li, H., Su, Y., Li, W., and Shi, C. G1/ELE functions in the development of rice lemmas in addition to determining identities of empty glumes. Front Plant Sci. 2016:71006. https://doi.org/10.3389/fpls.2016.01006.
Qin, X., Sun, J., Li, R., Cen, W., Li, R., and Luo, J. G1-mediated OsMADS1 repression regulates sterile lemma development in rice. Plant Cell Rep. 2025:44227. https://doi.org/10.1007/s00299-025-03619-2.
Rieu, P., Beretta, V., Caselli, F., Thévénon, E., Lucas, J., Rizk, M., Franchini, E., Caporali, E., Paleni, C., Nanao, M., Kater, M.M., Dumas, R., Zubieta, C., Parcy, F., and Gregis, V. The ALOG domain defines a family of plant-specific transcription factors acting during Arabidopsis flower development. Proc Natl Acad Sci U S A. 2024:121e2310464121. https://doi.org/10.1073/pnas.2310464121.
Sreenivasulu, N., Pasion, E., and Kohli, A. Idealizing inflorescence architecture to enhance rice yield potential for feeding nine billion people in 2050. Mol Plant. 2021:14861-863. https://doi.org/10.1016/j.molp.2021.05.003.
Yoshida, A., Suzaki, T., Tanaka, W., and Hirano, H. The homeotic gene long sterile lemma (G1) specifies sterile lemma identity in the rice spikelet. Proc Natl Acad Sci U S A. 2009:10620103-20108. https://doi.org/10.1073/pnas.0907896106.
Zhuang, H., Wang, H., Zhang, T., Zeng, X., Chen, H., Wang, Z., Zhang, J., Zheng, H., Tang, J., Ling, Y., Yang, Z., He, G., and Li, Y. NONSTOP GLUMES1 encodes a C2H2 zinc finger protein that regulates spikelet development in rice. Plant Cell. 2020:32392-413. https://doi.org/10.1105/tpc.19.00682.
罗曦, 魏林燕, 郑燕梅, 魏毅东, 连玲, 谢华安, and 吴方喜. 水稻护颖发育相关基因的研究进展. 南京农业大学学报. 2021:449.