2025年12月15日,广西大学亚热带农业生物资源保护与利用国家重点实验室明振华团队在Plant Communications发表了题为Structural basis of OsCERK1-mediated signal activation and transduction in rice immunity and symbiosis的研究论文。该研究解析了OsCERK1胞内激酶域的9种不同状态结构,揭示了其独特的中间态构象,并提出了“自磷酸化增强催化+底物结合变构激活”的双重调控模型,为理解植物如何精准协调免疫与共生信号提供了关键的结构基础。
01

研究背景
水稻作为全球重要的粮食作物,其生长发育过程中面临着复杂的环境挑战。一方面,水稻需要抵御稻瘟病菌等真菌病原体的侵染;另一方面,它又能与丛枝菌根真菌建立互利共生关系。几丁质激发子受体激酶1(OsCERK1)是协调水稻免疫与共生平衡的核心分子开关:在免疫中,它作为OsCEBiP的共受体识别长链几丁质;在共生中,它则与OsMYR1协作感知短链几丁质寡糖,从而激活不同的下游信号。虽然OsCERK1胞外信号感知机制已经被很好地表征,但其胞内激酶结构域的激活与信号转导的结构机制仍不清楚。
02
研究内容
1. 独特的中间构象
研究人员通过解析OsCERK1胞内激酶域在不同磷酸化状态(磷酸化或去磷酸化)和核苷酸底物结合(无核苷酸结合、ADP、ATP或ATP类似物AMP-PNP结合)下的9种截短结构,发现其区别于传统的激酶构象,始终采取一种介于“活性”与“非活性”之间的中间构象(aC-out和DFG-in)。该构象下,OsCERK1与ATP结合的结构元件处于激活状态,而与底物多肽结合的元件处于非激活状态,暗示从中间构象到激活构象的转变很可能由底物多肽结合触发。
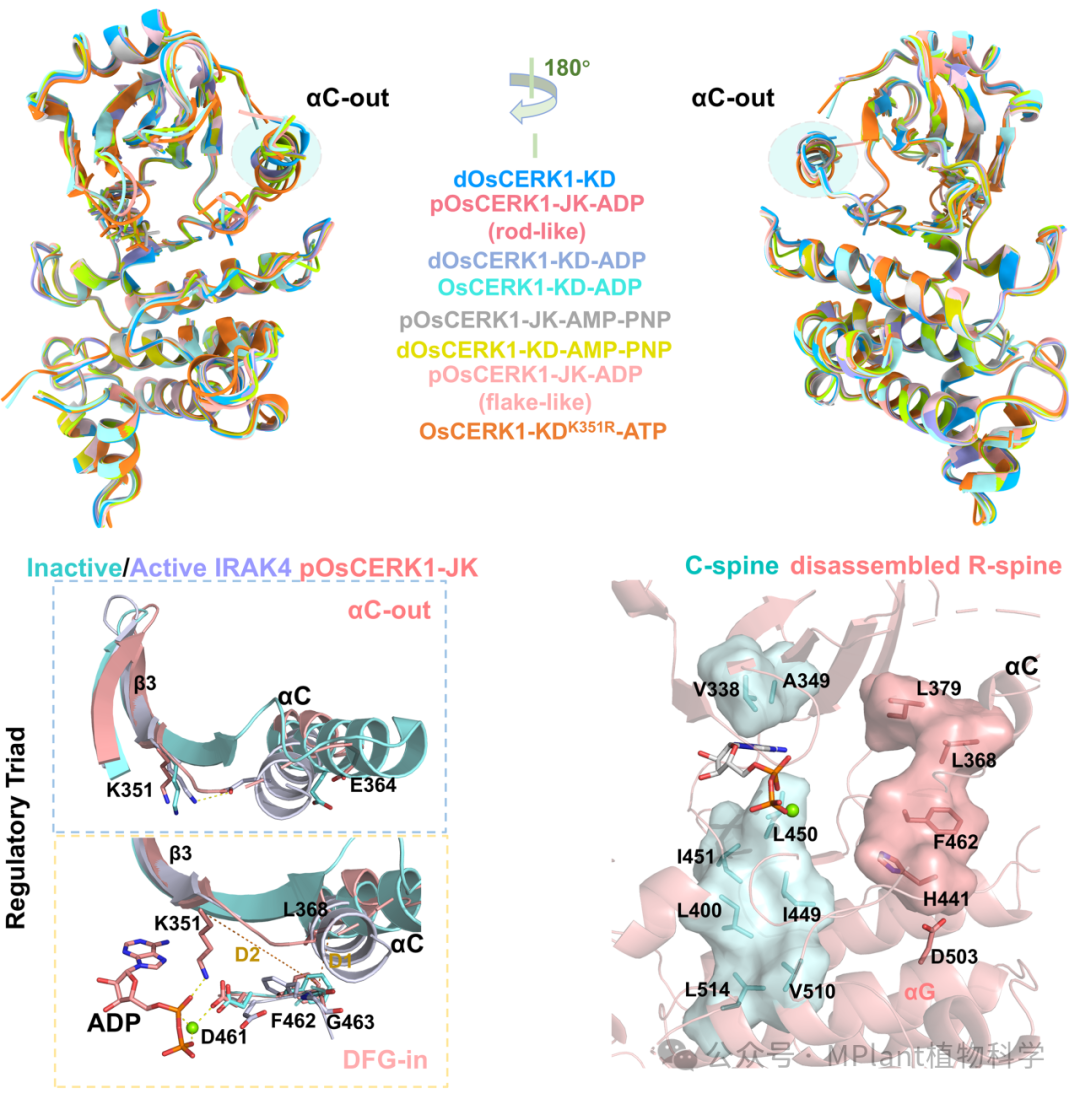
图1 OsCERK1在不同磷酸化状态、核苷酸底物结合、结构边界及晶体形状下的结构
2. 底物结合诱导变构激活
为了进一步探究底物多肽对OsCERK1的影响,研究人员对受体样细胞质激酶OsRLCK185和共生受体OsMYR1进行了研究。功能实验表明,底物OsMYR1和OsRLCK185均可变构增强OsCERK1的活性,其中OsMYR1的激活能力更强。这种增强作用与底物结合亲和力相关,而磷酸化并不总是能提高这种亲和力。
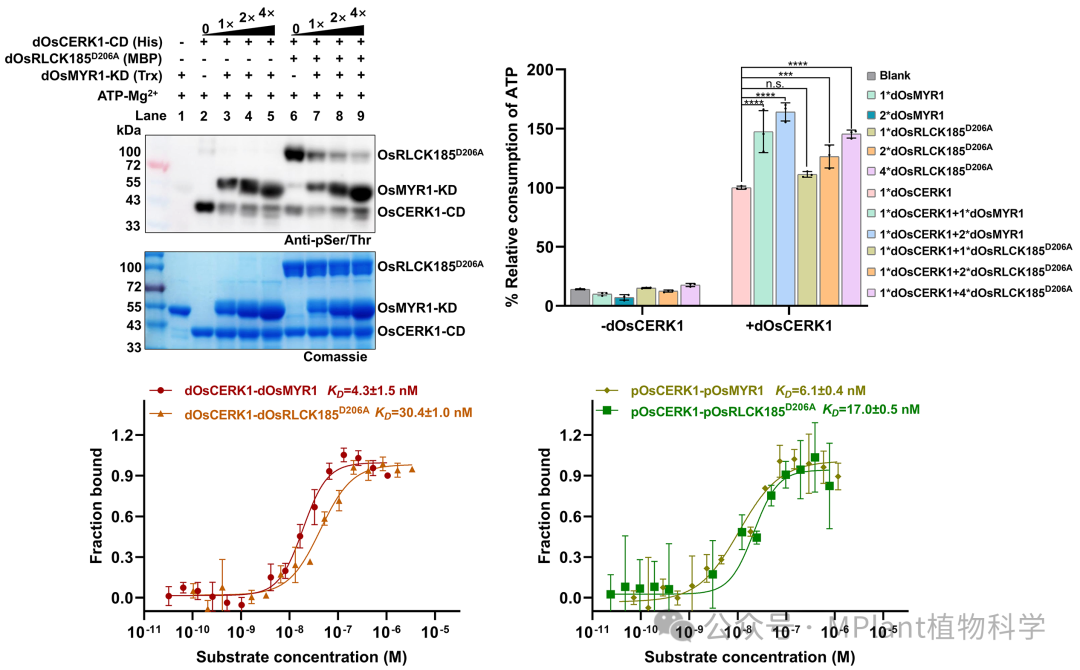
图2 OsCERK1被底物OsMYR1和OsRLCK185激活
3. 自磷酸化增强催化能力
自磷酸化对于许多激酶的激活至关重要。研究人员发现OsCERK1通过分子间自磷酸化显著提高了其催化活性,并证实激活段中的磷酸化位点T479、T484和Y492对OsCERK1的催化活性和底物磷酸化至关重要。
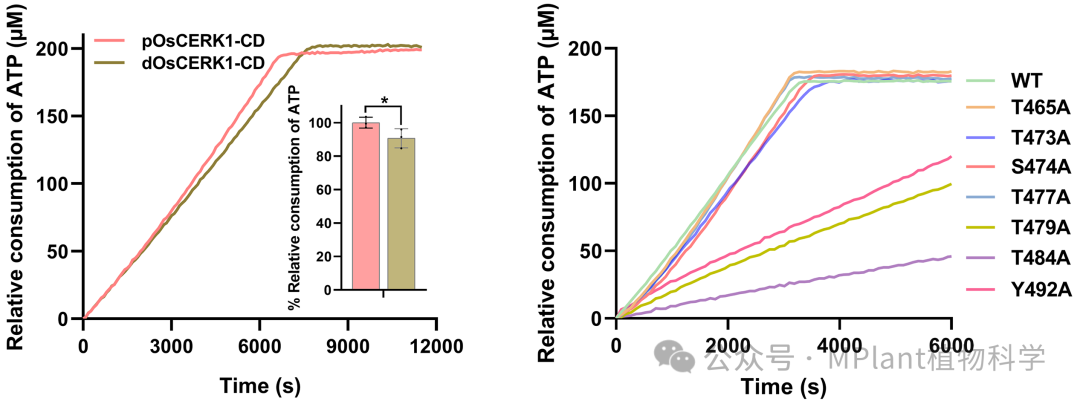
图3 OsCERK1与激活段磷酸化位点突变体的催化活性
4. OsCERK1信号转导的双重调控模型
基于此,研究人员提出了OsCERK1信号转导的双重调控模型,即自磷酸化增强催化能力,而底物结合诱导变构激活。在未磷酸化的静息状态下,OsCERK1的胞内结构域处于一种αC-out/DFG-in的中间构象,其中ATP结合元件处于激活构象,但多肽结合元件处于非激活构象。这种构象可防止OsCERK1自发激活,确保其信号转导依赖于几丁质感知和特异性底物结合。在识别几丁质寡糖后,OsCERK1通过其细胞外结构域二聚化,使细胞内结构域靠近,从而进行分子间自磷酸化,赋予其催化活性。随后,底物结合引发变构激活,伴随着αC螺旋从“外”到“内”的转变,使激酶完全激活,对底物进行转磷酸化,并启动下游信号转导。
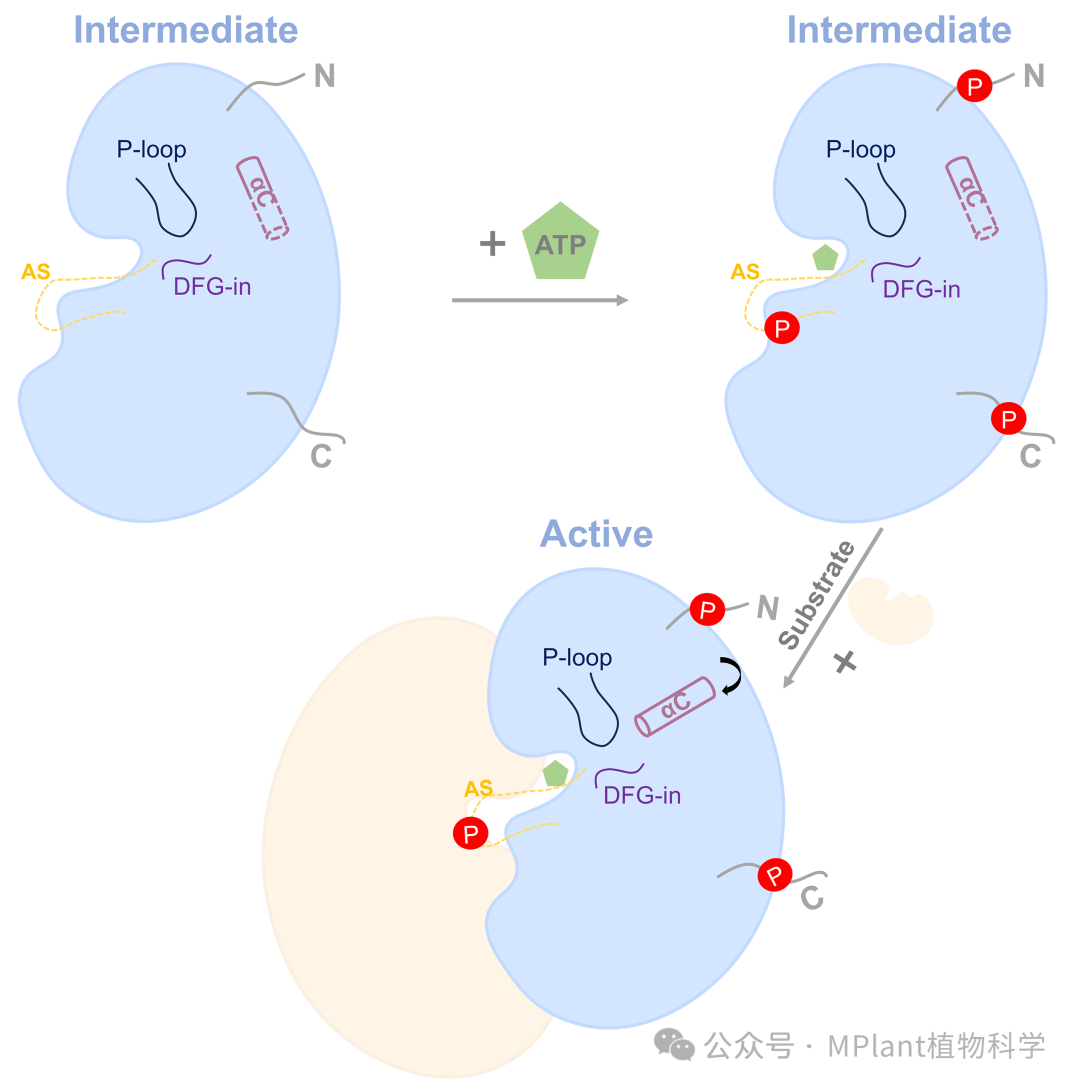
图4 OsCERK1信号转导的双重调控模型
综上,该研究不仅从结构层面阐明了OsCERK1的激活机制,更为深入解析植物免疫与共生过程中受体激酶介导的信号转导建立了重要的机制框架。
03
研究团队
广西大学生命科学与技术学院博士研究生苏子惠为论文第一作者,明振华教授为通讯作者。研究工作得到了国家自然科学基金、广西八桂青年拔尖人才培养项目、广西杰青基金、亚热带农业生物资源保护与利用国家重点实验室和广西研究生教育创新项目的资助。上海同步辐射光源、广西大学大型仪器设备共享平台为本研究工作提供了大力支持。