PCR是一种基本的DNA扩增技术,在分子生物学,合成生物学等研究中应用广泛。尽管各种PCR方法的不断改良,包括改造耐热性DNA聚合酶,但现有的大尺度PCR(Long PCR; Long Range PCR)方法仍很难从复杂基因组中特异地扩增大片段DNA(> ~10 kb),以便进行较长基因的功能、多基因簇和基因组结构变异等研究。另一方面,合成生物学正在成为一门重要学科,在学术研究和工业应用中日益重要。但DNA(基因)序列体外从头合成能力(一般一次体外组装3–4 kb以下)的限制性因素主要是对寡核苷酸引物模板拼接能力和扩增能力的不足。近年来,关于超大片段DNA扩增和体外大片段DNA合成相关的PCR方法鲜有报道。因此,在现代生物学研究中,亟待开发一种超大片段DNA扩增和体外大片段DNA从头合成的PCR新方法。
2021年12月29日,华南农业大学亚热带农业生物资源保护与利用国家重点实验室刘耀光院士和陈乐天教授团队在Molecular Plant在线发表了题为STI PCR: an efficient method for amplification and de novo synthesis of long DNA sequences的研究论文。该研究开发了一种适用于所有生物基因组的高效、特异地扩增超大片段DNA和体外大片段DNA合成的PCR新方法:抑制热交错PCR(Suppression Thermo-Interlaced PCR, STI PCR)。
该PCR方法结合了两个方面的原理。一是现有的Long PCR方法由于难以避免产生非特异产物,这些产物往往较短,必然对大片段目标序列产生较强的竞争性扩增,成为降低目标序列扩增效率的主要因素之一。为此,STI PCR在正/反向特异引物的5’端引入一段相同的短序列(Tm = 68–72℃),使扩增片段的DNA链末端形成反向互补序列。在使用较低的引物浓度下,长度较短的非特异产物链(包括引物二聚体)的两末端容易相互配对形成茎环结构而阻止引物的结合,使PCR扩增受到强烈的抑制(PCR Suppression, PS);而较大片段DNA链的两末端之间距离远,难以相互配对而PS效应较小,因此可以消除或减少非特异产物的竞争性扩增而强化目的大片段的特异性扩增。第二个原理是,由于长序列往往存在一些GC含量偏高和偏低的区域,在较高的延伸温度下(68–72℃)GC%偏低区域的双链结合不稳定而降低链延伸合成的效率。因此,STI PCR方法在链延伸阶段使用不同幅度(60–72℃)变温的嵌套热交错内循环(nested thermo-interlaced cycling, TIC),以优化具不同GC含量分布的目标DNA序列的链延伸效率,最终提高扩增效率(图1)。虽然两种因素的分别作用都能够一定程度地改善DNA长片段的扩增效率,但在STI PCR中,这两种因素的结合可以产生明显的对长片段DNA扩增效率和特异性的倍加效应。

图1. STI PCR工作原理图。TIC, thermo-interlaced cycling(内循环数n依目的片段长度而定)
另外,该研究还开发了一个在线工具calGC(http://skl.scau.edu.cn/calGC/, or http://www.ygliulab.club/calGC/),用于分析目标DNA序列的GC分布特征,并以此自动推荐一个合适的PCR热循环程序(图2)。
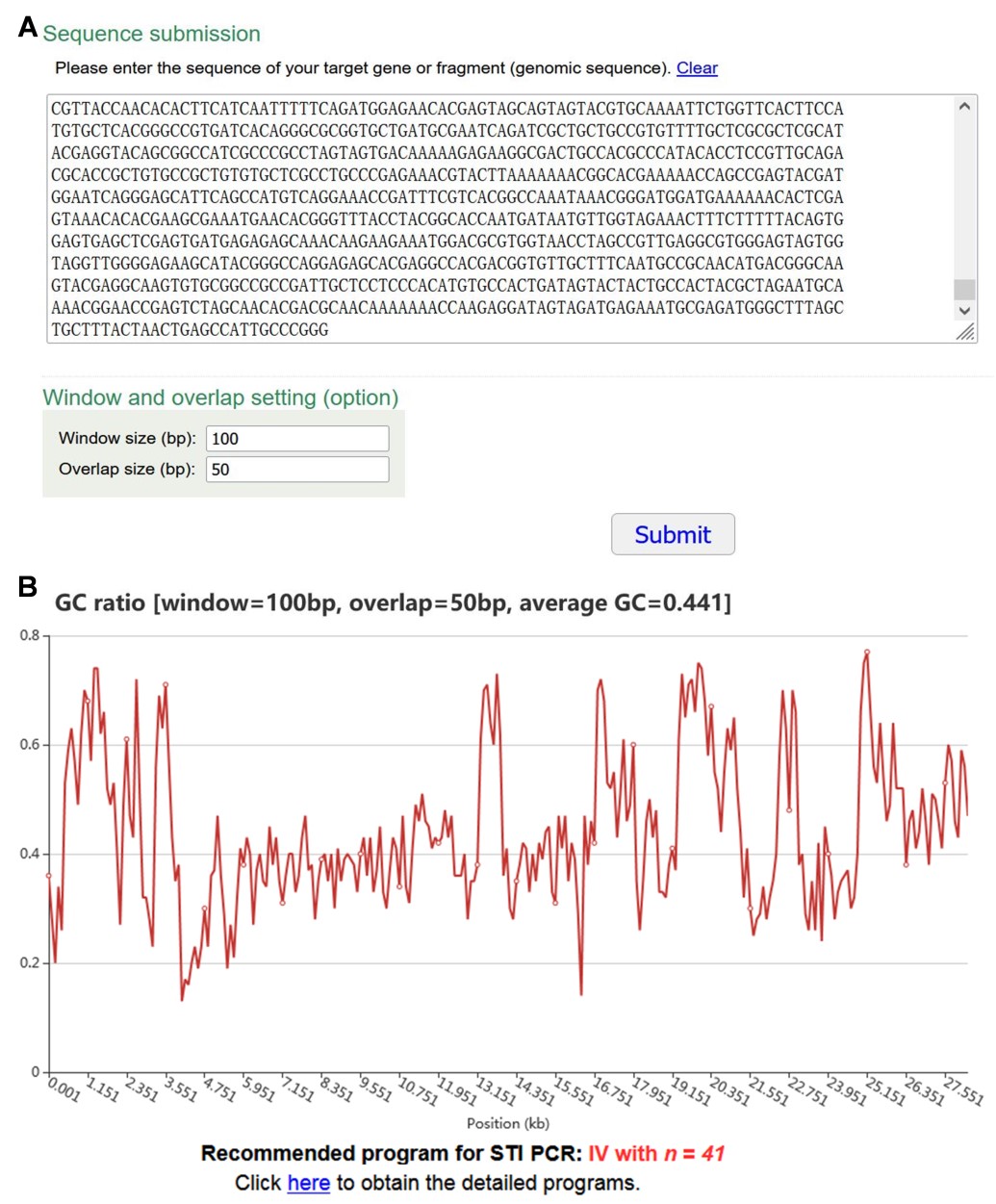
图2. calGC:DNA序列GC含量和分布特征分析网站的输入页面(A)和结果页面(B)
为了比较不同PCR方法对DNA长片段扩增的性能,该研究使用标准引物和抑制PCR引物,并结合常规热循环或嵌套热交错内循环条件,以水稻基因组DNA(CTAB法提取)进行了四组PCR扩增。结果表明,在使用相同的高性能耐热DNA聚合酶的测试反应中,只有STI PCR可以从水稻、玉米和人类细胞系等基因组中高特异性地扩增出从10 kb以上甚至30 kb以上(最高达38 kb)的各种长度的目标DNA片段(图3)。表明抑制PCR和嵌套热交错内循环这2个原理的结合产生了很强的扩增能力和特异性的叠加效应。这些扩增的大片段DNA可用于分子克隆和靶向基因组测序等研究,显示出STI PCR的重要应用价值。
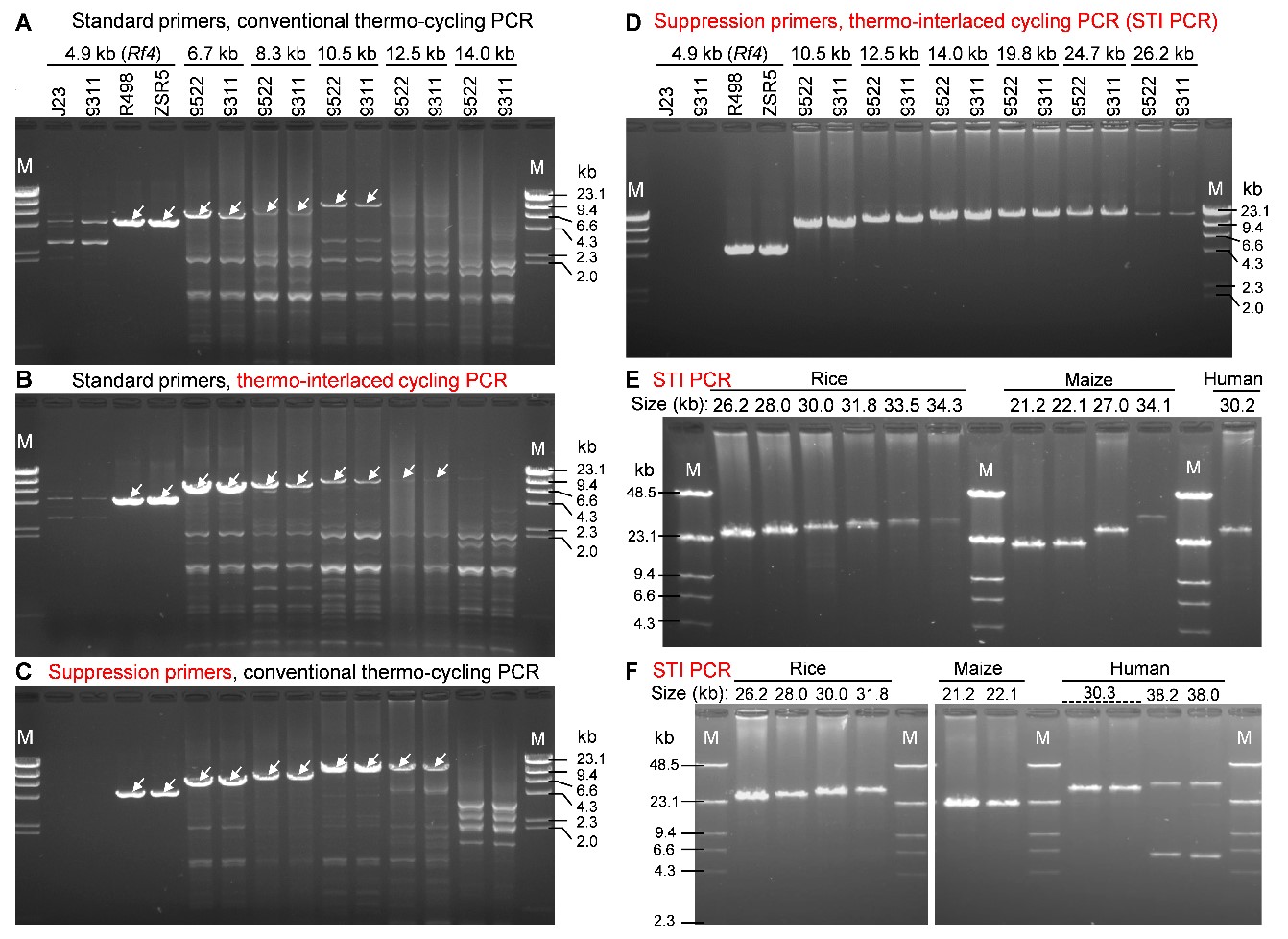
图3. STI PCR可实现基因组DNA超长片段的特异性扩增
目前,体外DNA合成的主流方法是,以化学合成覆盖目标序列的重叠的寡核苷酸引物,再通过聚合酶循环组装(Polymerase Cycling Assembly, PCA)或重叠PCR(overlapping PCR)法将寡核苷酸引物进行目标DNA模板拼接、再进行常规PCR扩增。但这种方法一次体外合成DNA片段的长度通常限制在约3 kb以内。该研究以使用了TIC的修饰PCA(modified PCA, mPCA)反应高效拼接出全长模板,再利用STI PCR高效扩增目标序列,一次体外从头合成达7 kb的重组基因序列(图4),克隆测序验证了此片段的正确组装。而且,该研究还利用mPCA-STI PCR将4个DNA片段(7.0 kb, 4.3 kb, 7.8 kb和5.3 kb)成功地组装为24.4 kb的连续片段(图4)。这些测试表明了STI PCR对大幅提升DNA合成和多片段组装能力的重要作用。
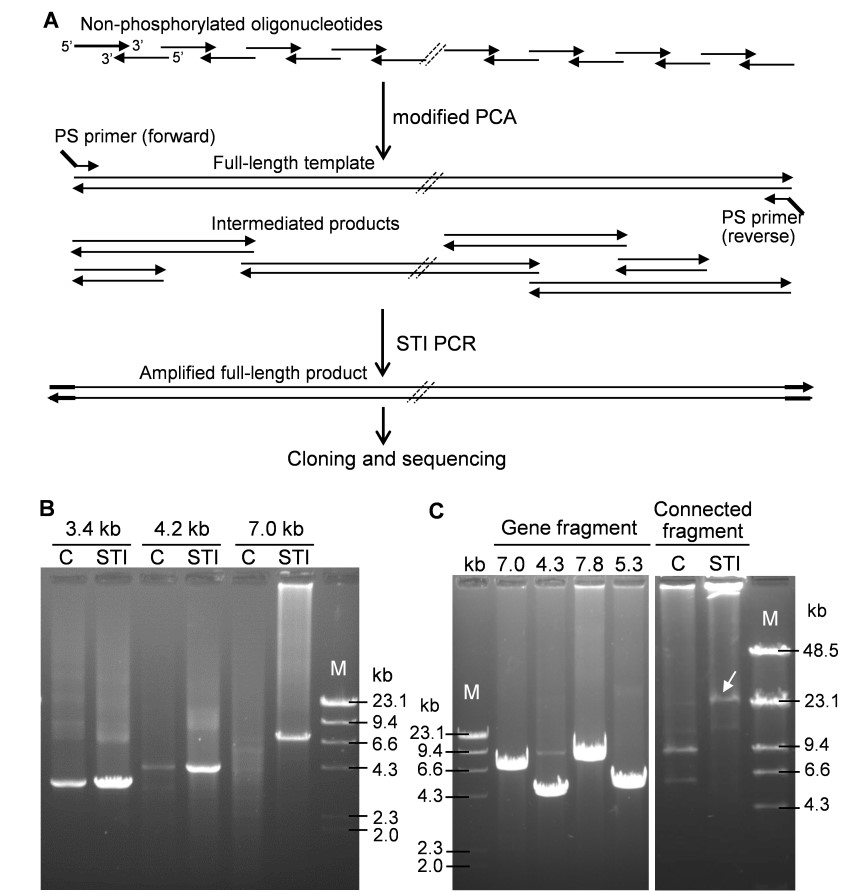
图4. STI PCR大大地提高了DNA体外从头合成和片段组装的能力。C为常规方法对照
综上,该研究开发的STI PCR突破了当前PCR方法在扩增DNA片段大小和特异性方面的局限性,极大地提高了超大片段DNA扩增和DNA从头合成及多片段组装的能力,可广泛应用于基因克隆、功能分析、测序和基因组结构变异检测等研究,是一种重要的技术进步。而且,该calGC网站工具也有助于研究人员在日常的分子生物学研究中分析DNA序列的GC含量和分布特征,这些技术将极大地推动分子生物学、合成生物学和生物技术的发展。
博士后赵哲、副教授谢先荣和讲师刘伟智为该论文的共同第一作者,刘耀光院士和陈乐天教授为共同通讯作者。该研究得到了国家自然科学基金创新研究群体项目、国家自然科学基金重大项目、广州市科技计划重点项目、广东省基础与应用基础研究重大项目和博士后科学基金面上项目的资助。